Видовете кристални решетки
Повечето от твърдите частици имат кристална структура, която се характеризира със строго определена конструкция на частиците. Ако частиците са кондиционирани за свързване линии, ние получаваме пространствен рамката, наречена кристалната решетка. Точките на която частицата има кристална решетка наречен възли. Възлите могат да бъдат измислени решетъчни атома. йони или молекули.
В зависимост от естеството на частиците, намиращи се на възлите, както и естеството на връзката четири вида кристални решетки разлика между тях йонен. метал. атомно и молекулно.
Наречен йонни решетка, в които йони възли.
Тези вещества образуват йонна връзка. В такива решетка възли разположени положителни и отрицателни йони, които са свързани помежду си чрез електростатично взаимодействие.
Йонни соли са кристалната решетка. алкален. активни метални оксиди. Йоните могат да бъдат прости или сложни. Например, натриев хлорид кристалната решетка възли са прости натриеви йони Na + и хлор Cl -. и в решетъчни възли калиев сулфат алтернативен прост калиеви йони К + комплекс и сулфатни йони S O 4 2 -.
Връзка между йони в такива твърди кристали. Следователно, твърдите йонни субстанции. огнеупорен. енергонезависима. Такива вещества лесно разтворими във вода.
Кристалната решетка на натриев хлорид

Кристал Натриев хлорид
Метални наречени решетка, които се състоят от положителни йони и метални атоми и свободни електрони.
Те образуват вещество с метална връзка. Местата на метална решетка са атоми и йони (атома, че йоните са лесно превърнати в атома, даващи техните външни електрони в обща употреба).
Такава кристална решетка характеристика на прости вещества от метали и сплави.
температура на топене метал могат да бъдат различни (от \ (- 37 ° С \) на живак до две хиляди триста градуса). Но всички метали имат характерен метален блясък. отстъпчивост. пластичност. добро поведение електрически ток и топлина.

Метални кристалната решетка

Наречен атомна кристална решетка, във възлите, които са отделни атоми свързани чрез ковалентни връзки.
Такъв тип решетка диамант - една от модификациите на въглероден алотропна. Вещества с атомна кристална решетка са въглерод. силиций. бор и германий. и комплексни съединения като силициев карбид SiC и силициев диоксид. кварц. кристал. пясък. които включват силициев оксид (IV) Si O 2.
Такива вещества се характеризират с висока якост и твърдост. По този начин, диамант е най-трудната естествено вещество. Y вещества с атомна кристална решетка много висока температура на топене и температурата на кипене. Например, температурата на топене на силикагел \ (1728 ° С \), макар да е по-висока графит \ (4000 ° С \). Ядрени практически неразтворими кристали.

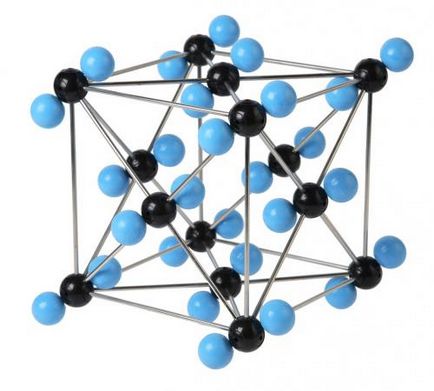
диамантени кристалната решетка

Molecular решетка наречени, в която възлите са молекули, свързани слаб междумолекулни взаимодействия.
Въпреки факта, че молекулите в атомите са свързани много силни ковалентни връзки между молекулите сами са слаби междумолекулни сили на привличане. Следователно, молекулни кристали имат ниска якост и издръжливост. ниски температури на топене и кипене точки. Много молекулно вещество при стайна температура са течности и газове. Такива материали са летливи. Например, кристално твърдо вещество йод и въглероден оксид (IV) ( «сух лед") се изпари, без да преминават течно състояние. Някои вещества имат молекулно миризма.
Този тип решетки са прости вещества в твърдо агрегатно състояние: благородни газове с едновалентни молекули (Той Ne Аг Кр Хе Rn .....), както и неметали с ди- или поливалентни молекули (Н О 2. 2. 2. N Cl I О 2. 2. 3. 4. S P 8).
Molecular кристалната решетка са също вещества с полярни ковалентни връзки: вода - лед. твърд амоняк. киселина. оксиди на неметалните елементи. Повечето органични съединения са също молекулно кристали (нафтален. Захарта. Глюкоза).
Кристалната решетка на въглероден двуокис