Полярни и неполярни молекули
Силови центрове на положителните и отрицателните заряди в молекулата, не съвпадат в един момент, но са на известно разстояние ℓ.
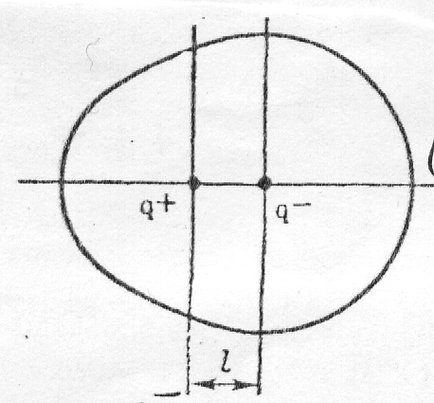
Polar молекула с постоянен електрически диполен момент
Молекула с обща неутралност представлява електрически дипол с заряд Q - - у хлорен атом и р + - водороден атом. Такива връзки и молекули са наречени полярни. Такси на атомите в молекулата нарича ефективен такси Q (молекула HCl QCL = -0,18; QN = 0.18 и абсолютен заряд на електрона, степента на ionicity на връзката
Измерва полярност връзка и молекулата - електрическа диполен момент (μ - «ц"), определена от продукта
μ = qℓ, CI ∙ m или μ = qℓ / 3,33 ∙ 10 -30. D
където Q - ефективното заряд; ℓ - дължина дипол. Устройството на диполен момент електрически (системата SI) се експресира от 3,33 ∙ ∙ Cl 10 -30 m (Кулон-м) = 1D (D - Debye).
Електрическият диполен момент - векторна величина. Посока на конвенционално взети от положителните към отрицателните товари - в посоката на преместване на свързващото вещество с електронен облак. Колкото по-голяма разлика в електроотрицателност елементи полярни молекули, колкото по-голяма електрическа диполен момент.
За полиатомични молекули, ние трябва да се направи разграничение на концепцията за диполни моменти на отделните връзки и молекулата като цяло. Поради наличието на множество връзки в молекулата си диполни моменти са оформени в съответствие с принципите на успоредник, в зависимост от формата на молекулата определя от ориентирани връзки Получената диполен момент се различава от диполни моменти на отделните звена в конкретния случай (за високо молекули) може да бъде нула, въпреки значително полярност на отделните връзки. Например, неполярен линеен CO2 молекула (μ = 0), а всяка С = О връзка има значително диполен момент (μ = 2.7 D).
2.7 D 2,7 г
Молекули, които съдържат неполярен ковалентна връзка, наречени неполярен или хомеополярно. Такива свързващи молекули са симетрично разпределени електронен облак между ядра на двата атома, и ядрото еднакво действа върху него. Примерите включват прости вещества на молекулата, състоящи се от атома на един елемент: Н2. Cl2. O2. N2. F2 и др. Електрически диполен момент на молекули е нула.
Способността на молекули (и отделни връзки) поляризира под въздействието на външно електрическо поле, наречено поляризуемост. Това може да стане под влиянието на областта създаден настъпването полярна молекула. Затова поляризуемост е от голямо значение в химични реакции.
Винаги е важно да се вземе предвид полярността на молекулата и електрически дипол момента. С най-новата свързаната с реактивността на вещества. Като цяло, колкото по-голяма електрическа диполен момент на молекулата, толкова по-реактивността на съединението. С електрически диполен момент тя е и свързани с тях вещества и разтворимост. Полярни течности са благоприятни електрически молекула дисоциация на електролити, разтворени в него на принципа на "като се разтваря като".