йонни уравнения
йонни уравнения
Както вече знаете от предишните уроци по химия, повечето от химическите реакции се срещат в разтвор. И тъй като всички разтвори на електролити включват йони, е възможно да се каже, че реакцията в разтвори на електролити са сведени до реакциите между йоните.
Това са реакции, които се появяват между йоните са наречени йонни реакции. А йонни уравнение - това е точно на уравнението на тези реакции.
Като правило, йонната уравнението на реакцията се получава от молекулни уравнения, но това е предмет на тези правила:
• Първо, формули слаби електролити, както и неразтворими и слабо разтворими вещества, газове, оксиди и т.н. под формата на йони не е записан, изключение от това правило е йон HSO-4, и след това в разредена форма.
• Второ, под формата на йони, обикновено са от формула силни киселини, основи, и водоразтворими соли. Трябва също да се отбележи, че тази формула, като Са (ОН) 2 се представя под формата на йони, в този случай, когато се използва вар вода. Ако се използва млякото на вар, която съдържа частици неразтворими Са (ОН) 2, с формула под формата на йони не са записани.
При изготвянето на йонни уравнения са склонни да използват пълноценно и съкращение йонна, т.е. кратко йонни уравнение. Ако разгледаме йонната уравнение, което е съкратена форма, тогава не спазва йони, т.е. те не съществуват от двете страни на общата йонна уравнение.
Нека да разгледаме примери за това как молекулярни писмено, дълги и къси йонни уравнения:
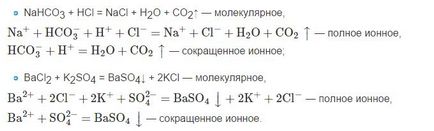
Поради това трябва да се забравя, че формулите на вещества, които не се разпадат, както и неразтворими и газообразен йон при получаването на уравнения обикновено написани на молекулна форма.
Също така, трябва да се помни, че ако веществото се утаява, следващото с формула представляват стрелката надолу (↓). Е, в случая, където газовата вещество от следващата формула трябва да бъде такава икона е стрелка сочи нагоре (↑) се освобождава по време на реакцията.
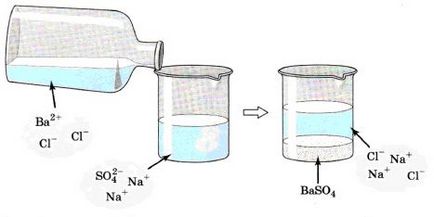
Нека да погледнем по-отблизо един пример. Ако имаме разтвор на натриев сулфат Na2SO4 и го добавя към разтвор на бариев хлорид BaCl2 (фиг. 132), виждаме, че сме се образува бяла утайка от бариев сулфат BaSO 4.
Виж внимателно изображението показва взаимодействието на натриев сулфат и бариев хлорид:
Сега нека да напише уравнението молекулярната реакция:
Е, сега нека да пренапише това уравнение, в което силни електролити са представени като йони, и реакциите, които излизат извън обхвата, са представени под формата на молекули:
Преди да записва цялото йонна уравнението.
Сега ние ще се опитаме да се премахне един от м другата страна на уравнението същите йони, т.е. тези йони, които не участват в реакцията 2Na + 2Cl и тогава ще получите съкращение йонни уравнение, което ще има следния вид:
От това уравнение се вижда, че цялата същност на тази реакция се редуцира до взаимодействието на бариев йони Ва2 + и сулфатни йони
и BaSO 4 утайка, която се образува не е дори независимо от това дали резултат, в електролита, който включва тези йони преди реакцията.
Как да решим уравнението йонна
И накрая, нека да обобщим нашия урок и да определи колко е необходимо за решаване на йонната уравнението. Ние вече знаем, че всички реакции, които се появяват в разтвори на електролити между йоните са йонни реакции. Тези реакции са взети за решаване или описани с помощта на йонни уравнения.
Също така, се помни, че всички тези съединения, които са летливи, е трудно разтворим или little- дисоциират намери решение на молекулна форма. Също така, не трябва да се забравя, че в случая, където се образува взаимодействието на електролитния разтвор съгласно всяка една от посочените по-горе видове съединения, това означава, че реакциите на практика не се срещат.
Условия на йонни разтвори на уравнения
За визуална например вземат образование умерено разтворими съединения, такива като:
Na2SO4 + BaCl2 + = VaSO4 2NaSl
Йонната формата на експресията ще бъде:
2Na + + + SO42- Ва2 + + 2Sl- = BaSO 4 + 2Na + + 2Sl-
Тъй като ние виждаме, че в отговор на отнеме бариеви йони и сулфатни йони и други йони не взаимодейства и състоянието им остава същата. От това следва, че можем да се опрости уравнението и пишат и в съкратен вид:
Ва2 + + SO42- = VaSO4
Сега нека си припомним, че трябва да се вземат в работата си с йонни уравнения:
• На първо място, е необходимо да се изключат от двете страни с еднакви йони;
• На второ място, ние не трябва да забравяме, че размерът на електрически заряди на уравнението трябва да е същата, както и в дясната му страна, а също и в ляво.