Йонийски уравнение - studopediya
Повечето химични реакции в разтвори. Електролитни разтвори, съдържащи йони и следователно реакционните разтвори на електролити са действително намалени до реакциите между йоните.
Реакциите между йоните са наречени йонни реакции и уравненията на такива реакции - йонни уравнения.
При изготвянето йон уравнение трябва да се ръководи от факта, че неразтворимата формула malodissotsiiruyuschih и газообразни записани в молекулна форма.
Бялото вещество се утаява, след това до претенциите постави стрелка, и ако той се освобождава по време на реакцията газообразно вещество, след това до претенциите поставени стрелка.
Ние презапис това уравнение, изобразяващи силни електролити под формата на йони и се простира от реакцията - под формата на молекули:
Записахме толкова пълна йонни уравнение.
Ако се изключат от двете страни на една и съща йони, която не участва в реакцията на лявата и дясната страна на уравнението), ние се получи намалена йонни уравнение:
По този начин, намаляват йонни уравнения са уравнения в общ вид, които характеризират естеството на химическата реакция показват който йони реагират и вещество, образувани като резултат.
обменни реакции йонни пристъпи към края в случаите, когато се формира или утаяване или malodissotsiiruyuschee вещество като вода. Бланширане към разтвор на натриев хидроксид, с фенолфталеин оцветени червено, свръхнапрежение излишния разтвор на азотна киселина, разтворът се обезцвети, който сигнализира химическата реакция:
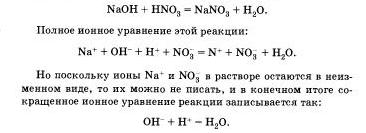
Това показва, че взаимодействието на силна киселина и алкални намалява взаимодействието на Н + йони и ОН - йони, което води до образуване malodissotsviruyuschee вещество - вода.
Споменатата реакция между силна киселина и алкален нарича неутрализация реакция. Това е специален случай на обменната реакция.
Такава реакция на обмен може да се получи не само между киселини и основи, но също така и между неразтворимите киселини и основи. Например, ако получават неразтворими синя утайка от меден хидроксид (II) сулфат, меден II чрез взаимодействие с алкален:
и след това разделяне на получената утайка на три части и нарастване на утайка в разтвор на първа тръба сярна киселина, за да се утаи втората тръба разтвор на солна киселина, и към остатъка в третата тръба разтвор на азотна киселина във всичките три флакона утайка се разтваря. Това би означавало, че при всички случаи няма химическа реакция, която отразява същността и с помощта на същата йонна уравнението.
За да видите това, имайте предвид, молекулните, дълги и къси йонни уравнения дадени реакции.
Да разгледаме йонни реакции, които се появяват с образуването на газ. Двете тръби изсипва 2 мл натриев карбонат и калиев карбонат. След това, в солна разтвор първия улов, а втората - на азотна киселина. И в двата случая се наблюдава характерно "кипене" се дължи на въглероден диоксид, отделян. Пишем за реакция уравнението за първия случай:
Реакциите в разтворите на електролитите, eapis кабина с помощта на йонни уравнения. Тези реакции се наричат обменни реакции на йони, както и в разтвори на електролити обменят йони. По този начин, могат да се направят два извода.
1. Реакциите във водни разтвори на електролити са реакции между йоните, и следователно изобразени като йонни уравнения.
Те са лесни за молекулярна и са по-общи.
2. обмен реакция йон в електролитни разтвори значително необратимо продължи само ако получената утайка malodissotsiiruyuschee газ или вещество.