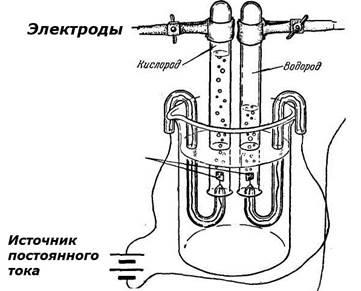
Електролиза - studopediya
Електролиза - набор от редокси реакции, проявяващи се при електродите по време на преминаването на директен електрически ток чрез електрохимична система, състояща се от два електрода и електролитен разтвор или стопилка.
В електролизата, химическа реакция от енергията на електрически ток. В катода, отрицателния електрод (-), там е процес на възстановяване, при анода положително зареден електрод (+) - процес на окисляване. Редуктивното и оксидативен действието на електрическия ток по-силен от ефекта на химически редуциращи средства и окислители. Устройството, което се извършва електролиза, наречена електролизера или електролитна вана. Естеството на потока в процеса на електролиза на електрода е силно повлиян от състава на електролита, разтворителя, материал електрод и условията на електролиза (напрежение, ток плътност, температура и т.н.).
Разграничаване електролиза на стопилки и електролитни разтвори. В последния случай, в процеса на електролиза включва водни молекули.
Електролиза на стопилки.
Ако стопилката на натриев хлорид потапя инертни електроди (въглища, желязо) и да премине директно електрически ток, йони ще се движат към електродите: Na + катиони към катода, анионите Cl - - към анода.
Окисляване възниква при възниква възстановяването на анод на катода (думи, започващи с гласна "а") (думата започва с съгласна "к").
Аниони - отрицателно заредени йони. Катиони - положително заредени йони.
натриеви йони Na +. достигане на катода, електроните са взети от нея и възстановени; хлор йони Cl -. даващи електроните анод окислени. Общо уравнение електролиза
NaCl → Na + + Cl -
(-) катод: Na + Na + + е Na →
(+) Анода: Cl - 2Cl - - 2е → Cl2
Общата схема на процеса на електролиза се стопи NaCl 2NaSl → 2Na + Cl2.
В електролиза на стопилки, съдържащи кислород-съдържащи аниони, кислород се отделя при анода. Това се дължи на образуването на окислението на нестабилни частици анодните ОН -. SO4 2- и т.н. веднага се разлага в стабилна неметални оксид и кислород.
Схема стопи електролиза на натриев сулфат може да бъде представена както следва:
(-) катод: Na + 2Na + + 2е → 2 Na
Общата схема на процеса на електролиза се стопи Na2 S04
Електролиза на разтворите.
При разглеждане на електролиза на водни разтвори трябва да се има предвид, че в допълнение към молекулите на електролит, водните молекули могат също да бъдат подложени на електрохимично окисляване или редукция. В този случай е необходимо да се вземе предвид стойността на капацитета на процеса на възстановяване на водородни йони, което е зависимо от концентрацията на Н +. В неутрална среда стойността е -0.41 V. последователностите катиони изпълнение на електролизата може да се настрои като се използва електрохимичната напрежение серия.
1. Катиони на метали, имащи потенциална стойност значително по-отрицателна от -0.41 V (Развитие потенциал водород) се намалява на катода (включително литий за алуминий) и водните молекули са намалени;
2. Катиони метали имат стандартен електрод потенциал стойност, близка до стойността на отделянето на водород потенциал (средната част на Zn серия метали, Cr, Fe, Cd, Ni) са намалени на катода заедно с водните молекули;
3. катиони на метали, които имат стандартен потенциал електрод по-висока от развитие на потенциала за водород, електролизата почти напълно редуцирани в катода.
Когато водният разтвор съдържа катионите на различни метали, изборът на електролизата катода ще тече в низходящ ред на алгебрични стойности на стандартната потенциал електрод. Така, смес от Ag + катиони. Cu 2+. Fe2 + първо ще се възстанови сребърни катиони (Е о = + 0.80 V), след това медни катиони (Е о = 0.34 V) и последната - катиони желязо (Е о = - 0.44 V). Естеството на реакции, проявяващи се при анода зависи от наличието на водни молекули, и върху материала, от който е направена анода. Разграничаване неразтворими и разтворими аноди.
Неразтворимите аноди от графит, платина. В електролиза, неразтворимите анодите не изпращат електрони към външна верига, тяхното попълване се осъществява чрез окисление на аниони и водни молекули. В този случай, аниони на водородни киселини, когато те са достатъчни концентрации на окислени доста лесно. Ако разтворът съдържа аниони на кислород-съдържащи киселини (SO4 2- NO3 -.... CO3 2- и PO4 3- т.н.), след това анода не се окислява тези йони и водни молекули.
В зависимост от рН на разтвори на вода окисляване протича по различен начин. В алкална среда, има реакция 4ON - - 4 = O2 + 2Н2 О.
кисела или неутрална среда 4д на 2Н2 + = О O2 + 4Н +.
В тези случаи, електрохимично окисляване на вода е най-енергично благоприятен процес. Кислород-съдържащи аниони или не са в състояние да се окисли, или тяхното окисляване се извършва при много високи потенциали. Например, окисляване потенциал на йони SO4 2-
Тя е равна на 2,01 V, което е значително по-висока от окисляване потенциал на вода 1,23 V.
В случай на неразтворим анод, електроните в външната верига изпраща самата анод. Разтворими аноди са направени от мед, сребро, цинк, кадмий и други.
Да разгледаме няколко примера за електролиза на водни разтвори на електролити. Електролиза на концентрирания разтвор на калиев йодид с въглеродните електроди.
В разтвор са gidrotirovannye йони и K + J -. както и молекула вода. Когато протича ток през разтвор на К + катиони се движат към катода, анионите J - - към анода. Въпреки това, реакции, проявяващи се при електродите са съществено различни от реакциите в стопени соли. Така, в катода вместо калиеви йони (в напрежението на ред е той алуминий) възстановяване на молекула вода. Схема KJ електролиза разтвор с въглеродните електроди показани на Фиг.
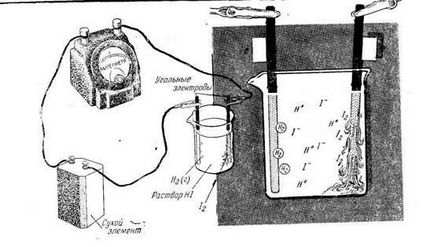
Схема електролиза KJ (разтвор)
Схема електролиза KJ → К + + J -
Общата схема на процеса на електролиза KJ 2 + 2Н2 О → Н2 ↑ + 2KOH + J2 ↑.
В резултат на електролиза в катодното водородът се освобождава при анода - йод натрупва в катодното пространство калиев хидроксид.
Електролиза на калиев сулфат с въглеродните електроди. Тъй като калий в електрохимичната серия е значително по-рано от водород, тогава катода ще се възстанови вода, се натрупват и освобождаване водородни йони ОН -. В анода, кислородни йони и Н + се натрупват. При разбъркване, това ще бъде неутрален разтвор. Шофиране електролиза
Общата схема на процеса на електролиза
Електролизата на воден разтвор на калиев сулфат се редуцира до електролизиран водата